Το αμερικανικό FDA εγκρίνει θεραπεία που επανασχεδιάζει τα κύτταρα για την καταπολέμηση του καρκίνου
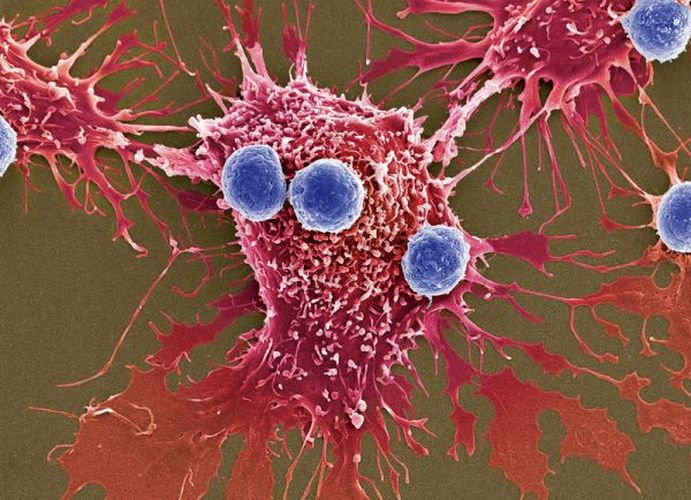
Σε μια απόφαση που θα αλλάξει για πάντα την έρευνα και τη θεραπεία του καρκίνου, η Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) ενέκρινε μια επαναστατική θεραπεία για τον καρκίνο την Τετάρτη, καθιστώντας την πρώτη γενετική θεραπεία που βασίζεται σε κύτταρα τώρα διαθέσιμη στις Ηνωμένες Πολιτείες.
Δείτε επίσης....
Η απόφαση - την οποία ο οργανισμός αποκαλεί "μια ιστορική δράση" - ήρθε περισσότερο από ένα μήνα μετά από μια επιτροπή της FDA συνέστησε τη θεραπεία .
Η νέα θεραπεία ονομάζεται θεραπεία CAR-T, που προηγουμένως αναφέρεται ως CTL019. Λειτουργεί με τη χρήση κυττάρων Τ του ίδιου του ασθενούς (ενός τύπου ανοσοκυττάρων) για την καταπολέμηση του καρκίνου. Τα κύτταρα εξάγονται από ασθενείς και τροποποιούνται για να μεταφέρουν ένα νέο γονίδιο, το οποίο θα κωδικοποιεί μια συγκεκριμένη πρωτεΐνη γνωστή ως χιμαιρικός υποδοχέας αντιγόνου ή CAR (έτσι η ονομασία θεραπεία CAR-T). Τα τροποποιημένα Τ κύτταρα τοποθετούνται πίσω στο σώμα του ασθενούς, όπου θα αρχίσουν να προσβάλλουν καρκινικά κύτταρα.
Ο φαρμακευτικός γίγαντας Novartis, ο οποίος έχει ασχοληθεί με τη θεραπεία, την ονόμασε Kymriah. Το FDA το έχει εγκρίνει για χρήση ενάντια σε ένα ιδιαίτερα ισχυρό είδος καρκίνου του αίματος που ονομάζεται οξεία λεμφοβλαστική λευχαιμία (ALL). Η έγκριση καλύπτει τη χρήση του Kymriah για τη θεραπεία παιδιών και νεαρών ενηλίκων ηλικίας έως 25 ετών που μπορεί να μην ανταποκρίνονται στη συνήθη θεραπεία ή έχουν υποτροπιάσει. Σε κλινικές δοκιμές, η γονιδιακή θεραπεία αποδείχθηκε αποτελεσματική, παράγοντας συνολικό ποσοστό απομάκρυνσης 83% στους 63 παιδιατρικούς και νεαρούς ενήλικες ασθενείς μέσα σε μόλις τρεις μήνες. Σύμφωνα με πληροφορίες, η Novartis χρεώνει 475.000 δολάρια για μια εφάπαξ θεραπεία, αν και υπόσχονται να μην χρεώνουν ασθενείς που δεν θα ανταποκριθούν εντός ενός μηνός.
Σύμφωνα με το Εθνικό Ινστιτούτο Καρκίνου , υπάρχουν περίπου 3.100 νέες περιπτώσεις ΟΛΟΥ κάθε χρόνο στις ΗΠΑ που αφορούν ασθενείς ηλικίας 20 ετών και νεότερους. "Το Kymriah είναι μια πρώτη προσέγγιση θεραπείας που καλύπτει μια σημαντική ανεκπλήρωτη ανάγκη για παιδιά και νέους ενήλικες με αυτή τη σοβαρή ασθένεια", δήλωσε ο Peter Marks, διευθυντής του Κέντρου Αξιολόγησης και Έρευνας Βιολογικών Ερευνών του FDA (CBER) . "Όχι μόνο η Kymriah παρέχει σε αυτούς τους ασθενείς μια νέα θεραπευτική επιλογή, όπου υπάρχουν πολύ περιορισμένες επιλογές, αλλά μια επιλογή θεραπείας που έχει δείξει πολλά υποσχόμενη μείωση και επιβίωση σε κλινικές δοκιμές".
Αυτή η εναλλακτική θεραπεία είναι σίγουρα ενθαρρυντική για τους ασθενείς - ειδικά επειδή το Kymriah μπορεί να αποδειχθεί πιο αποτελεσματικό από τη συμβατική θεραπεία. Για το FDA, είναι σίγουρα κάτι περισσότερο από μια καλύτερη θεραπεία: η έγκριση του Kymriah είναι ουσιαστικά ένα νεύμα για τα οφέλη της γονιδιακής θεραπείας .
"Εισερχόμαστε σε ένα νέο σύνορο στην ιατρική καινοτομία με την ικανότητα να επαναπρογραμματίζουμε τα κύτταρα των ασθενών για να επιτεθούμε σε ένα θανατηφόρο καρκίνο", ανέφερε ο επίτροπος της FDA Scott Gottlieb. "Οι νέες τεχνολογίες, όπως οι γονιδιακές και κυτταρικές θεραπείες, δίνουν τη δυνατότητα να μεταμορφώσουμε το φάρμακο και να δημιουργήσουμε ένα σημείο καμπής στην ικανότητά μας να θεραπεύουμε και να θεραπεύουμε πολλές ασυγκράτητες ασθένειες. Στο FDA, είμαστε αποφασισμένοι να βοηθήσουμε στην επιτάχυνση της ανάπτυξης και της αναθεώρησης πρωτοποριακών θεραπειών που έχουν τη δυνατότητα να είναι σωτήρια. "
Το Kymriah θα διατεθεί σταδιακά, ξεκινώντας από μόλις 32 νοσοκομεία και κλινικές όπου οι γιατροί και οι εργαζόμενοι στον τομέα της υγείας έχουν εκπαιδευτεί στη χορήγηση της θεραπείας. Ο FDA προειδοποίησε επίσης για πιθανή υπερβολική αντίδραση από το ανοσοποιητικό σύστημα, που ονομάζεται σύνδρομο απελευθέρωσης κυτοκινών, ως τον κύριο δυνητικό κίνδυνο της θεραπείας.
ΠΗΓΗ: www.futurism.com







